flavonoid procyanidin C1은 senotherapeutic activity를 가지고 있으며 쥐의 수명을 연장합니다.
추상적 인
장기의 노화 관련 기능 저하 및 노화 관련 만성 병리의 위험 증가는 부분적으로 노화 관련 분비 표현형(SASP)을 발생시키는 노화 세포의 축적에 의해 주도됩니다. 여기에서 우리는 포도씨 추출물(GSE)의 폴리페놀 성분인 프로시아니딘 C1(PCC1)이 노화 세포에 대한 작용을 통해 생쥐의 건강 수명과 수명을 증가시킨다는 것을 보여줍니다. 천연물 라이브러리를 스크리닝함으로써 우리는 GSE와 그 활성 성분 중 하나인 PCC1이 노화 세포에 특정한 영향을 미친다는 것을 발견했습니다. 낮은 농도에서 PCC1은 SASP 형성을 억제하는 것으로 보이지만 더 높은 농도에서는 활성 산소 종의 생성과 미토콘드리아 기능 장애를 촉진함으로써 노화 세포를 선택적으로 죽입니다. 설치류 모델에서 PCC1은 치료로 손상된 종양 미세 환경에서 노화 세포를 고갈시키고 화학 요법과 함께 투여할 때 치료 효능을 향상시킵니다. 방사선 조사, 노화 세포 이식 또는 자연적으로 노화된 늙은 쥐에 PCC1을 간헐적으로 투여하면 신체 기능 장애를 완화하고 생존을 연장합니다. 우리는 PCC1을 생체 내 활성과 노화 관련 병리를 지연, 완화 또는 예방하기 위한 임상 개입으로 추가 개발 가능성이 높은 천연 노화 치료제로 식별합니다.
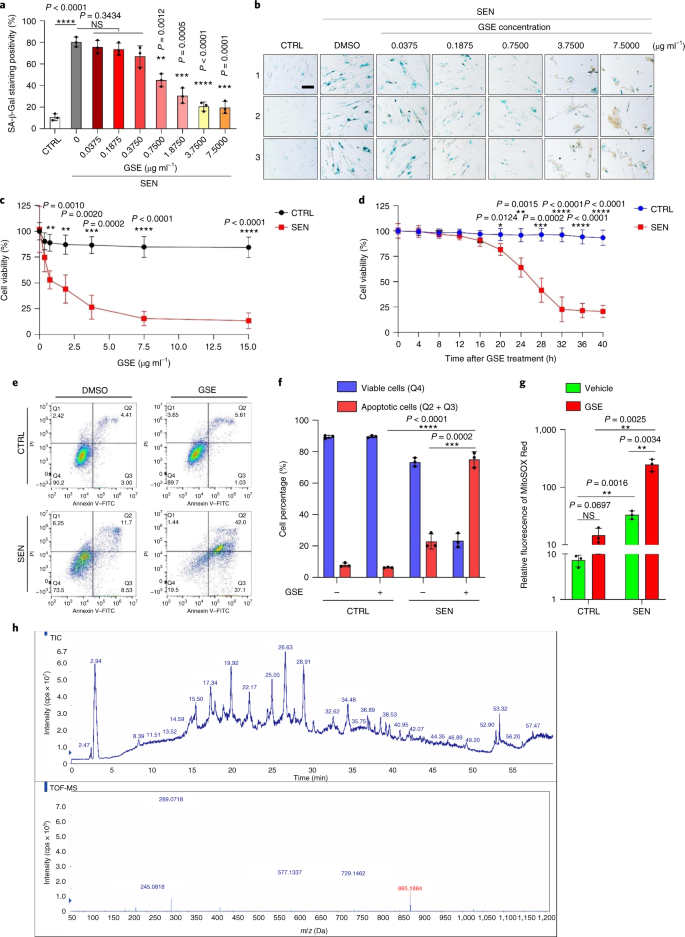
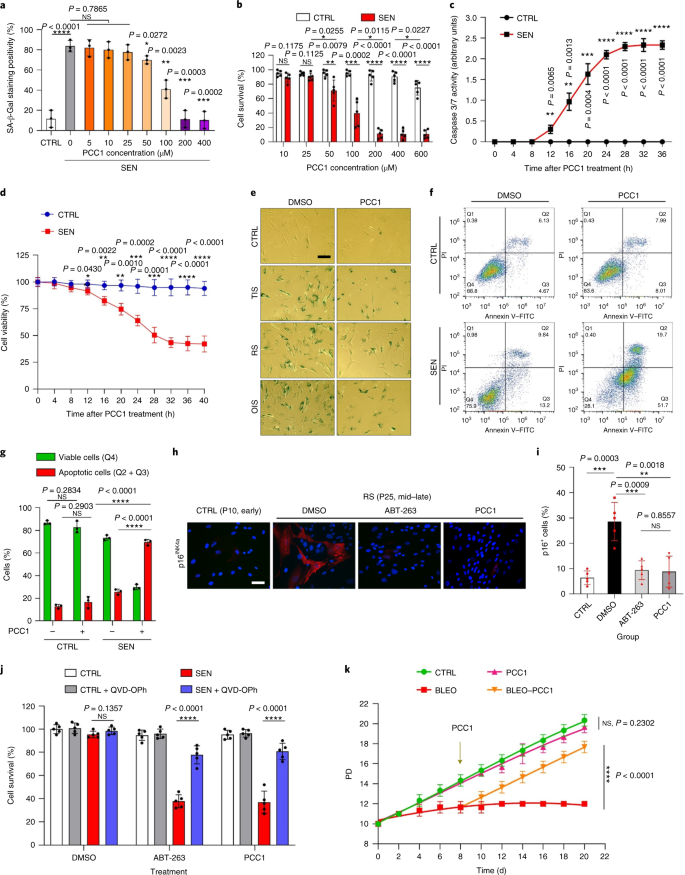
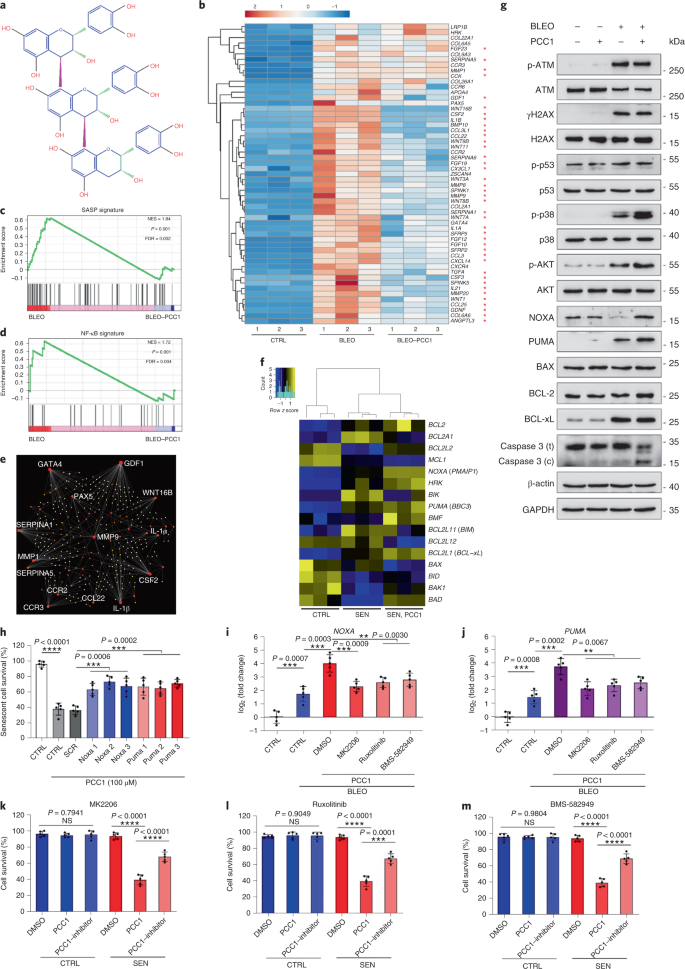
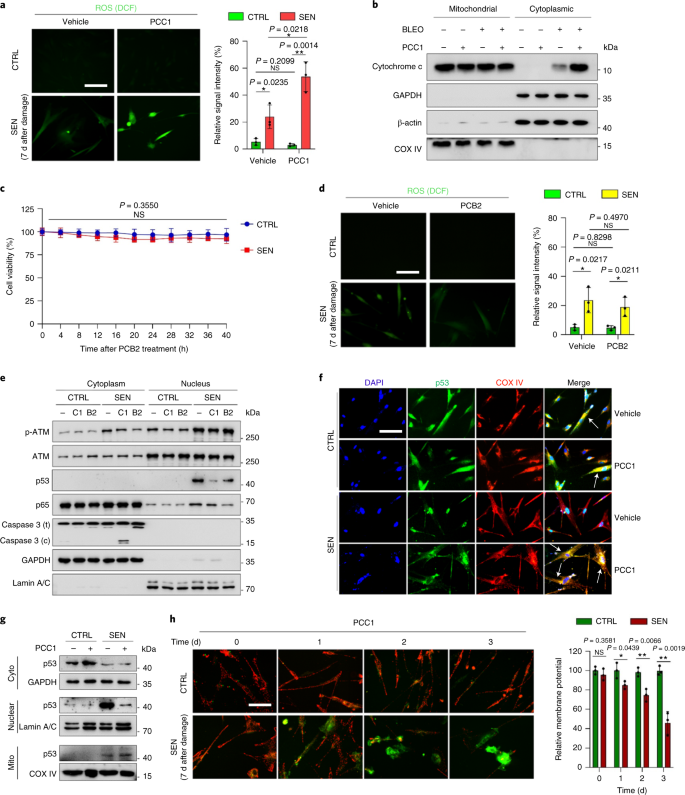
노화는 심혈관 질환, 대사 장애, 신경퇴행성 병리 및 다양한 악성 종양을 포함하는 만성 질환의 가장 큰 위험 요소 중 하나이며, 이들은 함께 전 세계적으로 이환율, 사망률 및 건강 비용의 대부분을 차지합니다.1. 최근 몇 년 동안 제2형 당뇨병, 골다공증, 골격 취약성 및 혈관 기능 장애와 같은 개별 연령 관련 질환을 치료하기 위한 특정 약제를 개발하는 데 상당한 진전이 있었습니다. 그러나 만성 질환의 이환율과 사망률을 조절하는 데 이러한 약물의 결합 효과는 미미했으며 이러한 질병은 복합 질환과 동시에 발생하는 경향이 있으며 유병률은 70세 이후 기하급수적으로 증가합니다.2. 건강수명과 수명에 영향을 미치는 몇 가지 주요 요인은 다양한 종에 대한 연구를 통해 확인되었으며 9가지 특징으로 분류할 수 있는 노화 메커니즘으로 정의되었습니다.3. 이러한 근본적인 노화 메커니즘 중에서 세포 노화는 여러 노화 동반 질환을 예방하거나 지연시키는 약물 작용 과정을 나타내기 때문에 상당한 관심을 받았습니다.4. 1960년대에 처음 보고된 세포 노화는 본질적으로 되돌릴 수 없는 복제 정지, 심각한 염색질 변화, 세포자멸사 저항성 및 증가된 단백질 합성을 포함하는 세포 상태를 말하며, 종종 전염증성 사이토카인의 과잉 생산으로 절정에 달합니다. 노화 표현형 및 다양한 연령 관련 병리를 유도합니다.5. 노화 마커 p16에 대해 양성인 노화 세포의 절제잉크4A 조직 퇴화를 완화하고 동물의 건강 기간을 연장하여 노화 세포가 유기체 노화의 원인 역할을 한다는 주장을 뒷받침합니다.6,7. 전임상 연구의 성공은 선택적 약리학적 제거를 통해 생체 내 노화 세포의 부담을 줄일 수 있는 잠재력과 함께 여러 인간 질병에 대한 세놀리틱스를 포함하는 개념 증명 임상 시험의 시작에 영감을 주었습니다.8,9,10. 2015년 첫 발견 이후(ref. 11), 소수의 합성 또는 소분자 세놀리틱 제제가 현재 알려져 있습니다. 표적화 전략은 주로 노화 세포가 세포 사멸에 저항하는 메커니즘을 기반으로 하며, 이는 장기간 동안 노화 세포 생존을 허용하는 노화 관련 항세포사멸 경로에 의존하는 것으로 보입니다.12,13. senolytics의 간헐적 투여는 환자가 불리한 상태로 발전할 위험을 줄이고 약물의 표적 외 효과를 최소화하며 암세포와 구별되는 특성인 분열하지 않는 노화 세포의 약물 내성 발병을 예방할 가능성이 있습니다. 암세포는 종종 항암 요법에 대한 내성을 제공하는 유리한 돌연변이를 획득합니다. 그러나 대부분의 보고된 세놀리틱은 세포 계통 또는 세포 유형에 의존하거나, 대안적으로 생체 내에서 상당한 세포독성을 나타내므로 임상 목적으로의 잠재적 사용을 제한합니다. 이 연구에서 우리는 노화 방지제로 구성된 천연물 의약 라이브러리를 스크리닝하고 GSE를 포함한 여러 후보를 식별했습니다. 추가 분석은 GSE 플라보노이드의 B형 삼량체 에피카테킨 성분인 PCC1이 낮은 농도에서 SASP 발현을 억제하고 더 높은 농도에서 노화 세포를 죽이는 데 중요한 역할을 하는 것으로 나타났습니다. 전임상 데이터는 PCC1이 기존 화학 요법과 함께 여러 마우스 모델에서 종양 크기를 크게 줄이고 생존을 연장할 수 있음을 시사했습니다. 따라서 PCC1은 노화를 지연시키고 노화 관련 장애를 개선하는 천연 공급원에서 분리된 새로운 종류의 식물화학적 세놀리틱을 나타내며 임상 의학에서 잠재적인 노화 방지제로서 추가 탐구가 필요합니다. 노화 세포를 효과적으로 조절할 수 있는 새로운 화합물을 식별하기 위해 46개의 식물 유래 약재로 구성된 식물화학 라이브러리(PDMA 라이브러리)를 사용하여 편향되지 않은 제제 스크리닝을 수행했습니다. 우리는 이 목적을 위한 세포 기반 모델로 1차 정상 인간 전립선 기질 세포주인 PSC27을 사용했습니다. 주로 섬유아세포로 구성되지만 내피 세포 및 평활근 세포를 포함하는 비섬유아세포 계통의 소수 비율과 함께 PSC27은 그 자체로 1차 세포주이며 유전독성 화학요법 또는 이온화 방사선과 같은 스트레스 요인에 노출된 후 전형적인 SASP를 발생시킵니다.14,15,16,17. 우리는 이 세포를 사전 최적화된 치사량 이하의 블레오마이신(50 μg ml-1) 7-10일 후 노화 관련 β-갈락토시다아제(SA-β-Gal) 염색 증가, 5-브로모데옥시우리딘 혼입 감소 및 DNA 손상 복구(DDR) 초점 증가가 관찰되었습니다(보충 그림 4). 1a – c). 우리는 개별 의약품이 노화 세포의 생존 및 발현 프로파일에 미치는 영향을 비교하기 위해 스크리닝 전략을 설정했습니다(Extended Data Fig. 1a). 세놀리틱 제제의 한 가지 유망한 이점은 ABT-263, ABT-737 및 다사티닙과 케르세틴의 병용과 같은 노화 세포의 예정된 사멸을 선택적으로 유도한다는 것입니다.11,18,19. 우리는 먼저 노화 PSC27 세포에 대한 이러한 노화 방지 약물의 효능을 테스트하여 약물 스크리닝을 위한 실험적 세포 모델로서의 잠재력을 입증했습니다. 우리의 예비 데이터는 이들 화합물 각각이 노화 세포를 상당히 고갈시켰지만 세포를 증식시키지 않았으며, 따라서 추가 연구를 위해 이 기질 라인을 사용할 가능성을 확인했습니다(Extended Data Fig. 1b). PDMA 라이브러리의 대규모 스크리닝에서 우리는 배양에서 노화 세포를 선택적으로 죽일 가능성이 있는 여러 화합물을 확인했습니다(Extended Data Fig. 1c-e). 예비 노화 방지 효과를 나타내는 약제 중에는 GSE, 퀘르세틴, 피세틴, 커큐민 및 피페론구민이 있습니다(Extended Data Fig. 1d, 전자). 케르세틴과 피세틴은 유사한 화학 구조를 공유하고 유사한 의약 효과를 발휘하며 둘 다 세놀리틱으로 알려져 있습니다.11,20,21. Curcumin과 piperlongumine은 또한 최근에 발견된 세놀리틱 잠재력을 가진 천연 화합물입니다.22,23. 우리는 크게 탐색되지 않은 소스로 남아 있는 GSE에 집중하기로 결정했습니다. 시험관 내 조건에서 GSE는 0.1875μg ml에서 최대 효율로 SASP를 억제했습니다.-1 (확장 데이터 그림. 2a), 그것은 senomorphics의 속성과 일치합니다.24. 더 낮거나 더 높은 농도의 GSE는 아마도 증가된 세포 독성의 결과로 세포 스트레스 반응의 유도로 인해 덜 효과적이었습니다(Extended Data Fig. 2a). RNA-seq를 사용하여 우리는 GSE로 처리하면 유전자당 2.0배의 변화에서 2,644개의 유전자가 하향 조절되고 1,472개의 유전자가 상향 조절되어 노화 세포의 발현 프로파일이 크게 변경되었음을 발견했습니다.피 < 0.01) (확장 데이터 그림. 2b). SASP와 무관한 몇몇 유전자의 발현은 전형적인 SASP 인자와 유사한 경향을 나타내었지만(Extended Data Fig. 2c), 우리의 유전자 세트 농축 분석(GSEA)의 데이터는 SASP의 분자 서명의 감소된 발현 또는 전염증성 표현형의 핵심 매개체인 핵 인자(NF)-κB 복합체의 활성화를 뒷받침했습니다(Extended Data Fig. 2d, 전자). NF-κB 복합체의 주요 소단위 중 하나인 p65의 핵 전위가 노화 세포에서 관찰되었으며, 이는 SASP 발현에서의 기능적 관여와 일치합니다14 (확장 데이터 그림. 2f). 참고로, 이러한 경향은 낮은 농도(예: 0.1875 μg ml)에서 GSE에 의해 실질적으로 길항되었습니다.-1). 반대로, NF-κB 신호전달의 활성화는 억제되지 않았지만 GSE가 더 높은 농도(예: 3.7500μg ml-1), 이러한 치료 조건에서 노화 세포의 차등 반응을 제안합니다. 핵 분획에서 ATM 키나제의 인산화에 의해 입증된 DDR 신호전달의 활성화 및 세포질 분획에서 관찰된 SASP 특징 중 하나인 C-X-C 모티브 케모카인 리간드(CXCL)8의 발현은 NF와 일치했습니다. 이러한 설정에서 -κB 활성화(Extended Data Fig. 2f). 단백질-단백질 상호작용 프로파일링은 세포 노화에 따라 크게 상향조절되지만 일단 세포가 GSE에 노출되면 하향조절되는 여러 요인을 포함하는 매우 활성적인 네트워크를 보여주었다(Extended Data Fig. 3a). 유전자 온톨로지 프로파일링은 이러한 분자가 생물학적 과정에 기능적으로 관여하고 일반적으로 SASP의 분비된 특성과 일치하는 세포 구성요소와 연관되어 있음을 보여주었습니다(Extended Data Fig. 3b,c). 따라서 GSE는 특정 농도 범위 내에서 사용될 때 노화 세포인 SASP의 전염증 프로파일을 제어할 수 있는 잠재력을 보유한 천연 제품입니다. GSE가 우리의 세포 기반 분석에서 세놀리틱 효능을 가진 유일한 천연 제품은 아니지만(Extended Data Fig. 1d, 전자), 우리의 후속 연구는 GSE에 주로 초점을 맞추었습니다. GSE의 노화 방지 능력이 특히 두드러지기 때문입니다. SASP를 senomorphic 에이전트로 감소시키는 GSE의 효능을 감안할 때, 우리는 다음으로 senolytic으로 작용하여 더 높은 농도에서 노화 세포를 죽이는 이 천연 산물의 잠재력을 조사했습니다. SA-β-Gal 염색은 노화 세포가 0.75 μg ml의 GSE 농도에서 제거되었음을 나타냅니다.-1 (무화과. 1a,b). 3.75μg ml에서-1 GSE, 20% 노화 세포 생존의 고원에 도달했습니다(그림 1b). 1a,b). ㅏ, SA-β-Gal 양성에 의한 노화 PSC27 세포 생존의 정량화. 농도를 증가시키면서 배지에 GSE를 적용하였다. CTRL, 대조군(증식하는) 세포; SEN, 노화 세포; NS, 중요하지 않습니다. 피 값은 Tukey의 다중 비교 테스트를 사용하여 일원 분산 분석에 의해 계산되었습니다. 비, 다른 농도의 GSE로 PSC27 세포를 처리한 후 SA-β-Gal 염색을 표시하는 대표적인 이미지. 스케일 바, 20μm. 데이터는 세 가지 독립적인 실험을 나타냅니다. DMSO, 디메틸설폭사이드. 씨, GSE 처리 시 대조군 및 노화 PSC27 세포의 생존 분석(0.3750, 0.7500, 1.8750, 3.7500, 7.5000 및 15.0000㎍/ml 농도에서)-1, 각각). 데이터는 평균 ± sd로 표시되며 3개의 생물학적 복제에서 파생되었습니다(N = 3개의 독립적인 분석). 피 값은 양측에 의해 계산되었습니다. 티- 테스트. 디, 대조군 및 노화 PSC27 세포를 GSE(3.75μg ml-1). 데이터는 평균 ± sd로 표시되며 3개의 생물학적 복제에서 파생되었습니다(N = 3개의 독립적인 실험). 피 값은 양측에 의해 계산되었습니다. 티- 테스트. 그리고, annexin V-FITC 및 propidium iodide (PI) 키트 및 4,6-diamidino-2-phenylindole (DAPI) 염색으로 처리한 후 대조군 및 노화 PSC27 세포의 유세포 분석 측정을 통해 세포 사멸 정도를 결정합니다. Q1–Q4, 사분위수 1–4. 에프, 생존율의 비교 정량화(Q4, PI-아넥신 V-) 및 아폽토시스(Q2 및 Q3, PI+아넥신 V+ 그리고 파이-아넥신 V+, 각각) 3일 동안 비히클 또는 GSE로 처리된 대조군 또는 노화 집단의 세포(N = 3개의 생물학적으로 독립적인 분석). 피 값은 양측에 의해 계산되었습니다. 티- 테스트. G, 다양한 조건에서 PSC27 세포에서 미토콘드리아 과산화물 지시약인 MitoSOX Red의 형광 신호 측정. 피 값은 양측에 의해 계산되었습니다. 티- 테스트. 시간, HPLC-ESI-QTOF-MS 수행 후 GSE의 총 이온 크로마토그램(TIC) 및 염기 피크 크로마토그램을 보여주는 고해상도 질량 스펙트럼. 달리 표시되지 않는 한, 세포는 배양 조건에서 GSE 처리 후 3일에 관련 분석을 받았습니다. cps, 초당 카운트. 막대 그래프 및 회귀 곡선의 데이터는 평균 ± sd로 표시되며 3개의 생물학적 복제를 나타냅니다. NS, 피 > 0.05; *피 <0.05; **피 <0.01; ***피 <0.001; ****피 <0.0001. 세포 생존력 분석은 GSE가 노화 세포 사멸을 유도했지만 0.75μg ml의 농도에서 시작하여 증식 세포 사멸을 유도하지 않았음을 보여주었습니다.-1 (무화과. 1c). 7.50 μg ml의 농도에서-1, 생존하는 노화 세포의 비율은 약 10%로 감소한 반면, 증식 세포의 생존력은 15.00μg ml에서도 영향을 받지 않았습니다.-1 GSE(그림. 1c), 우리 세포 분석에 사용된 최고 농도는 senolytics의 주요 특성인 노화 세포에 대한 GSE의 탁월한 선택성과 특이성을 시사합니다. 다음으로 시간 경과에 따라 노화 세포를 차등적으로 표적화하는 GSE의 능력을 측정했습니다. 3.75㎍/ml 농도의 GSE 처리 시-1, 노화 세포의 생존력은 20시간 후에도 크게 감소하지 않았다. 노화 세포와 대조군(증식하는 세포) 사이의 생존율 차이는 32시간 후에 최대에 도달했으며, 이는 노화 세포 집단에서 세놀리틱에 대한 고유 내성의 이질성을 의미합니다(그림 1b). 1d). GSE는 노화 세포에 대해 뚜렷한 효과를 생성하므로 세포 사멸을 유도하는 GSE의 효능을 분석했습니다. 유세포 분석은 생존력이 유의하게 감소한 반면 노화 세포의 세포자멸사는 증가했지만 증식하는 세포의 세포자멸사는 증가하지 않은 것으로 나타났습니다(그림 1c). 1e,f 및 보충 그림. 2a). 미토콘드리아 기능 장애 및 대사 변화는 노화 세포 및 유기체 노화의 특징 중 하나이며, 산화 스트레스 및 슈퍼옥사이드와 같은 활성 산소 종(ROS) 생성을 유발하는 사건입니다.3,25. 미토콘드리아 과산화물 지시약인 MitoSOX Red를 사용했습니다.26, 세포 간 변화를 조사하기 위해 GSE가 노화 세포에서는 미토콘드리아 ROS의 생성을 촉진하지만 증식하는 세포에서는 촉진하지 않는다는 것을 발견했습니다(그림 1a). 1g). 따라서 우리의 데이터는 GSE가 시험관 내 미토콘드리아 스트레스의 악화와 세포자살 유도를 통해 노화 세포를 죽이는 모델과 일치합니다. 포도 씨는 건조 물질 기준으로 포도의 38-52%에 달하며 풍부한 항산화제 공급원을 구성합니다.27. 우리는 GSE의 주요 구성 요소를 식별하기 위해 전자 분무 이온화(ESI) 인터페이스가 장착된 사중극자 비행 시간 질량 분석(QTOF-MS)과 결합된 고압 액체 크로마토그래피(HPLC)를 적용했습니다. 우리는 페놀산, 플라보노이드(예: 플라반-3-올, 프로시아니딘) 및 기타 화합물을 포함하여 파이토케미컬의 세 가지 주요 범주를 발견했습니다(그림 1). 1시간 및 보충 표 1). 그 중 일부 성분은 프로시아니딘 및 그 유도체로 확인되었으며 미토콘드리아 단백질을 표적으로 하여 다발성 만성 질환을 완화시키는 것으로 보고되었습니다.28. 그러나, GSE의 세놀리틱 기능을 매개하는 주요 성분(들)은 크게 불분명합니다. 포도씨 프로시아니딘의 보고된 생물학적 활성에는 산화 손상 감소, 염증 억제 및 암세포 사멸 유도가 포함됩니다.29,30,31,32. GSE에서 발견되는 개별 화합물 중 PCC1은 DNA 손상을 유도하고 세포 주기 정지를 유발하며 체크포인트 키나제의 발현을 증가시키는 것으로 나타났기 때문에 특별한 주의가 필요합니다.33. HPLC-QTOF-MS에 의한 식물성 화학 물질 자체의 혼합물인 GSE의 예비 분석(총 이온 크로마토그램) 데이터는 특정 MS 피크에서 GSE의 프로파일이 화학적으로 순수한 PCC1의 크로마토그램 프로파일과 일치하므로 PCC1의 존재를 시사했습니다. 상업적 소스에서 획득(그림. 1시간 및 보충 그림. 2b). PCC1은 배양된 암세포에서 BCL-2의 수준을 낮추지만 조절인자 BAX의 발현과 카스파제 3, 9의 활성을 증가시키는 것으로 나타났으며, 따라서 세포자멸사 유도를 통해 잠재적으로 항암 효과를 발생시키는 것으로 나타났습니다.33. 따라서 우리는 다음으로 배양에서 노화 세포를 제거하는 PCC1의 능력과 선택성을 평가했습니다. 데이터는 PCC1이 50μM의 농도에서 시작하는 노화 간질 세포에 대해 세놀리틱이며, 이 농도에서 증식하는 세포는 크게 영향을 받지 않습니다(그림 1b). 2a,b 및 보충 표 2). 농도가 높을수록 노화 세포의 생존율이 낮아져 임계 값이 약 200μM이지만 PCC1은 600μM 이상에서 사용했을 때 대조군 세포에 대해서만 독성을 나타 냈습니다 (그림 1b). 2b). caspase 3/7 활성의 시간 경과는 PCC1이 12시간 이내에 세포자멸사 효과를 발휘하여 24시간에 안정기에 도달함을 나타냅니다(그림 3d). 2c). 이 발견은 생존력 측정과 대체로 일치했습니다(그림 1b). 2d). PCC1의 세놀리틱 특성은 복제 소진 또는 노화(RS) 또는 종양유전자(HRAS)로 인해 노화에 들어간 세포에 의해 확인되었습니다.G12V) 과발현(OIS)은 치료로 인한 노화와 유사한 스트레스 모욕을 유발합니다(그림 1). 2e, 확장 데이터 Fig. 4b – e 및 보충 표 2). 함께, 결과는 PCC1이 용량 의존적 방식으로 다른 자극에 의해 유도된 노화 인간 기질 세포를 선택적으로 제거하지만 적절한 농도에서 사용될 때 비노화 세포에 큰 영향을 미치지 않음을 시사한다. ㅏ, SA-β-Gal 염색에 의한 노화 PSC27 세포 생존의 측정. PCC1은 농도를 증가시키면서 적용되었습니다. 피 값은 Tukey의 다중 비교 테스트를 사용하여 일원 분산 분석에 의해 계산되었습니다. 비, 증가하는 PCC1 농도에서 블레오마이신에 의해 유도된 노화 PSC27 세포의 생존. 씨, 카스파제 3/7 활성에 대한 아폽토시스 분석. 디, PCC1 처리 후 PSC27 세포 생존력을 평가하기 위한 시간 경과 생존 곡선. 그리고, SA-β-Gal 염색의 이미지. TIS, 요법 유발 노화(블레오마이신에 의한). 스케일 바, 20μm. 데이터는 세 가지 독립적인 실험을 나타냅니다. 에프, annexin V-FITC 및 PI 키트로 처리한 후 유세포 분석 및 DAPI 염색을 통해 세포자멸사 수준을 결정합니다. G, 생존율의 정량화(Q4, PI-아넥신 V-) 및 아폽토시스(Q2 및 Q3, PI+아넥신 V+ 그리고 파이-아넥신 V+, 각각) 3일 동안 비히클 또는 PCC1 처리 후 세포(N = 3개의 생물학적으로 독립적인 분석). 시간, PSC27 세포의 면역형광 염색. RS는 PCC1 처리 전에 직렬 계대에 의해 유도되었습니다. 레드, p16잉크4a. 초기 계대(P10)의 세포를 음성 대조군으로 사용하였다. ABT-263(1.25μM)은 양성 대조군으로 테스트되었습니다. 스케일 바, 20μm. 나, 면역형광 염색 통계. 제이, 범-카스파제 억제(20μM QVD-OPh) 후 PCC1-유도된 세놀리틱 활성. 에게, 인간 MSC의 PD 분석. PCC1은 표시된 대로 실험 시작 후 8일째에 적용되었습니다. BLEO, 블레오마이신. 을위한 씨,디,에게, 데이터는 평균 ± sd로 표시되며 3개의 생물학적 복제에서 파생되었습니다(N = 3개의 독립적인 분석). 데이터의 경우 비-디,G,나,제이, 피 값은 양측에 의해 계산되었습니다. 티- 테스트. 에 대한 실험에서 씨-에게, PCC1은 100μM에서 사용되었습니다. 달리 표시되지 않는 한, PCC1 처리 후 3일째 분석을 위해 샘플을 수집했습니다. 막대 그래프의 데이터는 평균 ± sd로 표시되며 3개의 생물학적 복제를 나타냅니다. NS, 피 > 0.05; *피 <0.05; **피 <0.01; ***피 <0.001; ****피 <0.0001. 세포 계통 전반에 걸쳐 PCC1 효능을 실험적으로 확장하고 확립하기 위해 우리는 인간 태아 폐 섬유아세포(WI38), 1차 인간 제대 정맥 내피 세포(HUVEC) 및 인간 중간엽 줄기 세포(MSC)를 PCC1로 처리한 결과 이러한 모든 계통의 노화 세포가 PCC1에 의한 선택적 절제에 대한 유사한 감수성인 반면, 노화되지 않은 대응물은 생존 가능한 상태로 유지되었습니다(Extended Data Fig. 4f–h 및 보충 표 3). 우리는 유세포 분석에 의해 PCC1에 대한 반응으로 노화 세포에서 세포 사멸의 유도를 추가로 확인했지만 증식 세포는 PCC1에 크게 영향을받지 않은 채로 남아있었습니다 (그림 1c). 2f,g). 요약하면, 우리의 데이터는 PCC1이 다양한 세포 유형에 걸쳐 노화 세포를 선택적으로 제거하고 노화의 다양한 유발 요인에서 발생함을 보여줍니다. PCC1에 의한 노화 세포의 고갈을 시각화하기 위해 우리는 p16의 발현을 조사했습니다.잉크4aRS를 경험한 기질 세포에서 널리 사용되는 노화 마커. PCC1은 잘 확립된 합성 세놀리틱 제제인 ABT-263(1.25μM)과 대체로 유사한 효능으로 후기 계대 PSC27 집단에서만 나타나는 p16-양성 노화 세포를 효과적으로 제거했습니다.18,21 (무화과. 2시간, 나는). 노화 세포의 PCC1 매개 제거가 다른 형태의 프로그램된 세포 사멸보다는 주로 세포 사멸의 유도를 통해 발생한다는 것을 입증하기 위해 우리는 범-카스파제 세포 사멸 억제제 퀴놀릴-발릴-로 세포를 처리했습니다.그만큼-메틸아스파르틸-(-2,6-디플루오로페녹시)-메틸케톤(QVD-OPh). 노화 세포를 죽이는 PCC1의 능력은 QVD-OPh에 의해 역전되었습니다. 따라서 PCC1은 ABT-263과 함께 세놀리틱 특성으로서 카스파제 의존적 세포자멸사 유도를 공유합니다(그림 1b). 2j). 화학적 억제제를 사용한 추가 분석에서는 ferroptosis, pyroptosis 또는 necroptosis를 통한 PCC1 유도 세포 사멸을 제외했습니다(Extended Data Fig. 4i). 유전독성 약물로 치료한 후 세포 집단 배가(PD)의 가능성을 평가하기 위해 환경 스트레스에 노출된 후에도 자가 재생되고 콜로니 기반 증식을 재개할 수 있는 MSC를 사용했습니다.34, 손상의 이질성으로 인한 것일 수 있으며, 손상을 덜 받은 세포는 아마도 자가 회복 및 세포 주기 재진입 가능성을 유지할 수 있을 것입니다.24,35. 처리 후 빠르게 성장 정지에 들어간 블레오마이신으로 손상된 세포와 달리, PCC1을 사용한 노화 후 처리는 특히 SASP를 발생시키고 세포 집단 내에서 측분비 노화를 유도할 가능성을 유지하는 노화 세포를 제거한 후 MSC의 PD 능력을 유의하게 향상시켰습니다(그림 1a). . 2천). 그러나 PCC1 처리는 증식하는 세포의 PD에 영향을 미치지 않았으며, 이는 정상 세포와 비교하여 노화 세포에 대한 PCC1의 선택성을 추가로 나타냅니다. GSE는 항산화 및 항염증 활성이 보고된 많은 성분과 함께 복잡한 식물화학물질 혼합물이기 때문에27,36, 우리는 PCC1이 노화 세포 고갈에 관여하는 GSE의 주요 성분인지 또는 GSE의 대체 식물 화학 물질이 전반적인 세놀리틱 효과에 기여할 수 있는지 조사했습니다. 이를 위해 우리는 노화 PSC27 세포의 생존에 대한 개별 식물 화학 분자의 영향을 조사했습니다. 대부분의 GSE 구성 요소는 PCC1의 용량 범위에서 세놀리틱 활성을 나타내지 못했고 증식하는 세포의 심각한 사멸을 일으키지 않았습니다(보충 그림 2). 3 그리고 4). 플라보노이드 케르세틴은 이전 연구에서와 같이 세놀리틱 활성을 나타내었지만 천연 플라본과 공유되는 특성11,21, '재구성된 GSE', HPLC–QTOF-MS 데이터(보충 표 1, 케르세틴은 0.9%만 차지하지만 의도적으로 PCC1을 제외하면 두 분석에서 PCC1에 대해 관찰된 결과와 유사한 결과를 나타내지 않았습니다(보충 그림 3 그리고 4). 다른 구성 요소가 기여하는지 여부를 결론을 내릴 수는 없지만 우리의 데이터는 PCC1이 GSE의 세놀리틱 효과의 주요 매개체임을 분명히 시사합니다. 노화 세포 사멸을 선택적으로 유도하는 PCC1의 탁월한 효능을 감안할 때 우리는 기본 메커니즘을 조사했습니다. PCC1은 플라보노이드 슈퍼패밀리에 속하며 자유 라디칼을 제거하고 금속을 킬레이트화하며 과산화수소 형성을 감소시킬 수 있으며 구조의 기능적 '-OH' 그룹과 플라보노이드 분자의 고리 위치에 기인하는 항산화 특성27. 프로시아니딘의 항산화 능력은 부분적으로 중합 정도에 의해 좌우되는 반면, PCC1은 본질적으로 프로시아니딘 에피카테킨 삼량체입니다(그림 1). 3a). ㅏ, 삼량체 에피카테킨 PCC1의 화학 구조. 비, 상위 유전자(50)를 나타내는 히트맵은 노화 PSC27 세포에서 유의하게 상향조절되지만 PCC1 처리(50μM)에서는 하향조절됩니다. 빨간 별, SASP 요인. 씨, SASP 스펙트럼에서 중요한 유전자 세트의 GSEA 플롯. FDR, 허위 발견률; NES, 정규화된 농축 점수. 디, NF-κB 매개 신호 전달과 관련된 중요한 유전자 세트의 GSEA 플롯. 그리고, NetworkAnalyst의 전형적인 SASP 관련 인자의 단백질-단백질 상호작용 지도는 노화 세포에서 상당히 상향 조절되지만 PCC1 치료에 의해 하향 조절됩니다. 에프, 대조군, 노화 세포 및 PCC1 처리된 노화 세포에서 BCL-2 계열 유전자의 차등 발현을 보여주는 히트맵. G, 다른 약제에 노출된 PSC27 세포의 면역블롯. pro-apoptotic 및 anti-apoptotic 요인과 DDR 신호 전달 관련 분자의 발현을 조사했습니다. 카스파제 3(t), 총 카스파제 3; 카스파제 3(c), 절단된 카스파제 3; p, 인산화. β-액틴 및 GAPDH, 로딩 제어. 데이터는 세 가지 독립적인 실험을 나타냅니다. 시간, 세포를 표적으로 하는 세 가지 다른 짧은 머리핀 RNA 종으로 감염되었습니다. 부상 또는 퓨마 노화를 유도하기 위해 블레오마이신에 노출되기 전에. 7일 후, 세포에 3일 동안 PCC1(100μM)을 처리하여 세포자멸사를 유도하였다. SCR, 스크램블. 나, 부상 역전사(RT-qPCR)가 있는 정량적 PCR을 사용하여 발현을 결정했습니다. AKT, JAK1 및/또는 JAK2 또는 p38의 활성을 억제하기 위해 10μM MK2206, 10μM ruxolitinib 또는 20nM BMS-582949의 부재 또는 존재 하에 100μM PCC1에 3일 동안 노출되기 전에 세포를 블레오마이신으로 처리하여 노화를 유도했습니다. 각각 MAPK. 제이, 유사한 RT-qPCR 발현 분석 세트 퓨마 에 설명된 조건을 사용하여 나. 에게-중, MK2206의 부재 또는 존재 하에 PCC1 처리 후 세포 생존율 측정(에게), 룩소리티닙(엘) 또는 BMS-582949(중), 각각 AKT, JAK1 및/또는 JAK2 또는 p38 MAPK의 효소 활성을 억제하기 위해 포함됩니다. 데이터의 경우 씨,디, 피 값은 Tukey의 사후 비교를 사용하여 일원 분산 분석에 의해 계산되었습니다. 의 통계적 의미 시간-중 양면을 사용하여 계산되었습니다. 티- 검정 또는 일원 분산 분석(Dunnett의 검정). 모든 막대 그래프의 데이터는 평균 ± sd로 표시되며 3개의 생물학적 복제를 나타냅니다. NS, 피 > 0.05; *피 <0.05; **피 <0.01; ***피 <0.001; ****피 <0.0001. 우리는 먼저 노화 세포의 전사체 전체 발현에 대한 PCC1의 영향을 분석했습니다. 생물 정보학은 PCC1 처리 후 기질 세포에서 4,406개의 유전자가 유의하게 상향 조절되었고 2,766개의 유전자가 하향 조절되었음을 보여주었습니다(보충 그림 4). 5a). 우리는 세포 노화 동안 발현이 현저하게 상향 조절되었지만 노화 세포가 PCC1에 노출되었을 때 실질적으로 하향 조절되는 SASP 인자의 큰 배열을 관찰했습니다(그림 1a). 3b). GSEA 프로파일링은 SASP 및 NF-κB 시그니처가 모두 PCC1 처리에 의해 현저하게 억제됨을 보여주었다(도 2a). 3c,d). 우리는 또한 노화 동안 상향 조절되고 PCC1 처리 후 하향 조절되는 이러한 요인 사이의 다중 상호 상호 작용 또는 기능적 연결이 상위 차등적으로 발현되는 유전자 목록에 나타나는 것을 발견했으며, 대부분은 일반적으로 분비된 요인이었습니다(그림 1c). 3e). 노화 세포에 대한 PCC1의 선택성을 이해하기 위해 우리는 전사체 발현 프로필을 추가로 평가하고 PCC1이 몇몇 BCL-2 슈퍼패밀리 구성원에서 발현 변화를 유도한다는 것을 알아차렸습니다(그림 1a). 3f). DDR 신호 전달은 크게 영향을 받지 않았지만, PCC1 의존성 상향 조절 또는 p38 미토겐 활성화 단백질 키나아제(MAPK)의 활성화가 관찰되었으며, 이들 세포에서 카스파제 3 절단이 발생했습니다(그림 1a). 3g). BCL-xL 발현은 증식하는 대조군에 비해 노화 세포에서 증가했지만 PCC1 처리는 단백질 수준을 더 이상 향상시키지 않았습니다. 다른 두 BCL-2 요인인 BCL-2와 BAX의 수준은 크게 변하지 않았습니다. NOXA와 PUMA(BCL-2 상동성 도메인 3(BH3) 전용 pro-apoptotic subfamily의 두 구성원)는 세포 노화 동안 서로 다른 발현 패턴을 나타내었지만 PCC1 처리는 두 인자의 상향 조절을 초래했습니다(그림 1a). 3g). BCL-2 pro-apoptotic 요인의 넉다운은 NOXA와 PUMA가 PCC1의 세놀리틱 작용을 부분적으로 매개함을 시사했습니다(그림 1b). 3시간 및 확장 데이터 Fig. 5a–c). AKT 키나제, 야누스 키나제(JAK)1, JAK2 및 p38 MAPK 신호전달의 화학적 억제제를 사용한 치료는 또한 이들 신호전달 경로의 발현에 관여함을 시사했습니다. PMAIP1 (부상) 그리고 BBC3 (퓨마) 및 PCC1 처리 후 노화 세포 사멸(Fig. 3i-m). 쓰러뜨리면서 부상 그리고 퓨마 PCC1의 세놀리틱 효과를 부분적으로만 억제했다(Fig. 3h, k – m), 우리는 노화 세포 사멸로 이어지는 다른 가능한 메커니즘을 조사했습니다. 프로시아니딘은 일반적으로 세포 생존력을 증가시키고 ROS 생성을 감소시키며 포유동물 세포의 산화 스트레스를 억제하기 때문에37,38, 우리는 다음으로 PCC1에 노출된 노화 세포에서 유사하거나 항산화 효과가 관찰될 수 있는지 물었다. 놀랍게도 우리는 노화된 PSC27 세포가 증식하는 세포와 대조적으로 PCC1로 처리될 때 상승된 ROS 수준을 나타내기 때문에 반대의 경우라는 것을 발견했습니다(그림 1b). 4a 및 확장 데이터 Fig. 5d, 2'-7'-디클로로디히드로플루오레세인 디아세테이트(DCFH-DA) 프로브의 신호에 유의하십시오. 자유 라디칼 소거 활성이 있는 안정한 레스베라트롤 유사체인 HS-1793으로 치료39, PCC1으로 처리된 노화 세포에서 ROS 생성을 효과적으로 차단했습니다(Extended Data Fig. 5e,f) 반면, ROS 수준은 PCC1 처리된 노화 세포를 프로토노포어 미토콘드리아 언커플러인 CCCP에 노출시킨 후 추가로 증가했습니다.40, 또는 ruxotemitide(LTX-315), 외부 미토콘드리아 막의 투과를 유도하는 양친매성 양이온성 펩타이드41, 각각은 대조군 세포에 세포독성이 아닌 농도로 적용되었다(Extended Data Fig. 5e,f). CCCP 또는 ruxotemitide 자체로 치료하면 ROS 생성이 향상되었지만 효과는 일반적으로 PCC1에 의해 유도된 것보다 작았으며 이는 PCC1이 노화 세포에서 미토콘드리아 기능 장애를 유발함을 시사합니다. 노화 세포의 아폽토시스 지수(카스파제 3/7 활성)를 측정함으로써, 우리는 PCC1-유도 효과가 각 미토콘드리아 교란 물질과 PCC1의 조합에서 더욱 향상될 수 있지만 HS-1793과의 공동 처리에서는 억제된다는 것을 발견했습니다(Extended Data Fig. . 5g). ㅏ, 세포 산화 환원 상태의 변화에 민감한 세포 투과성 형광 프로브인 DCFH-DA를 사용한 ROS 수준 측정. 실험은 PCC1 처리 1일 후에 수행되었습니다. 왼쪽, 대표 이미지. 스케일 바, 10μm. 맞아, 통계. DCF, 디클로로디히드로플루오레세인. 비, 다른 치료법에 세포를 노출시킨 후 면역 블롯. 미토콘드리아와 세포질 사이의 사이토크롬 c 분포는 PCC1 처리 후 3일째에 세포질 상청액에서 미토콘드리아를 분리하여 프로파일링되었습니다. COX IV는 미토콘드리아 호흡 사슬의 말단 효소이자 미토콘드리아 마커입니다. 씨, 천연 프로시아니딘 계열의 또 다른 구성원인 PCB2로 처리 시 PSC27 세포 생존력을 평가하기 위한 시간 경과 생존 곡선. 데이터는 평균 ± sd로 표시되며 3개의 생물학적 복제에서 파생되었습니다(N = 3개의 독립적인 분석). 디, 에 기술된 것과 유사한 방식으로 수행된 ROS-생산 분석 ㅏ, 셀이 PCB2에 노출되었다는 점을 제외하고. 스케일 바, 10μm. 그리고, 세포질과 핵 사이의 ATM, p53 및 caspase 3의 발현 및 분포의 면역블롯. GAPDH 및 라민 A/C, 각각 세포질 및 핵에 대한 로딩 제어. C1, PCC1; B2, PCB2. 에프, 비히클(DMSO) 또는 PCC1으로 세포를 처리한 후 면역형광 염색의 공초점 현미경. p53 또는 COX IV에 특이적인 1차 항체를 적용했습니다. 스케일 바, 10μm. G, 다른 제제에 노출된 PSC27 세포의 면역블롯 분석. 세포질, 세포질; 미토, 미토콘드리아. 시간, Δψm을 나타내는 형광 프로브인 JC-1 염색 분석. 신호는 3일 동안 측정되었습니다. 녹색 형광은 JC-1 단량체를 나타냅니다(미토콘드리아 막 탈분극 후 세포질에 나타나고 초기 단계 세포자멸사를 나타냄). 적색 형광은 JC-1 응집을 나타냅니다(손상되지 않은 미토콘드리아에 상주). 왼쪽, 대표 이미지. 맞아, 통계. PCC1과 PCB2는 모두 관련 분석에서 100μM에서 사용되었습니다. 데이터 비,그리고-G 세 가지 독립적인 실험을 대표합니다. 의 통계적 의미 ㅏ (오른쪽), 디 (오른쪽) 그리고 시간 (오른쪽)은 양측을 사용하여 계산되었습니다. 티-테스트, 그리고 그 안에 씨 일원 분산 분석(Dunnett's test)으로 계산되었습니다. 모든 막대 그래프의 데이터는 평균 ± sd로 표시되며 3개의 생물학적 복제를 나타냅니다. NS, 피 > 0.05; *피 <0.05; **피 <0.01. 시토크롬 c 방출 및 미토콘드리아 막 파괴는 세포사멸과 관련된 세포 내 사건이며 종종 직접적인 세포사멸 동인으로 작용합니다42. 우리의 데이터는 PCC1 처리가 미토콘드리아에서 주변 세포질 공간으로의 사이토크롬 c 방출을 향상 시켰음을 시사합니다 (그림 1b). 4b 및 확장 데이터 Fig. 5시간). 미토콘드리아에서 시토크롬 c의 방출은 PCC1 처리된 노화 세포에서 카스파제 활성화와 같은 생화학적 반응과 대체로 일치합니다(그림 1b). 3g). 프로시아니딘 계열의 구성원은 노화 세포를 PCC1로 치료할 때 관찰한 것과 반대되는 항산화 및 항염증을 비롯한 광범위한 약리학적 특성을 나타냅니다. 현재 데이터는 PCC1의 효과가 다른 프로시아니딘에 의해 재현되는지 여부를 추론하게 했습니다. Procyanidin B2(PCB2)는 이량체로 존재하는 대표적인 플라보노이드로 배양 세포에서 산화 스트레스 동안 ROS 수준을 감소시킵니다.43. PCB2는 노화 세포를 제거하지 못했습니다(그림. 4c 및 보충 그림. 3b 그리고 4b) ROS 생성이 향상되지 않았고 노화 세포에서 시토크롬 c의 미토콘드리아 방출도 유도되지 않았습니다(그림 1a). 4d 및 확장 데이터 Fig. 5i). NF-κB 복합체의 주요 소단위 중 하나인 상당한 양의 p65(RelA)가 노화 세포의 핵으로 전위되어 있다(Fig. 4e). PCB2 처리가 항염증 능력과 일치하는 p65 핵 전위를 억제했지만, 이 효과는 PCC1에 의해 재현되지 않았습니다(그림 1a). 4e). PCC1에 노출된 노화 세포는 현저한 caspase 3 절단을 보인 반면, PCB2로 처리된 세포는 그렇지 않아 이 두 프로시아니딘 분자의 생물학적 활성을 더욱 분화시켰습니다(그림 1a). 4e). 기능적으로 세포 운명을 지배하는 인자로서, p53은 pro-apoptotic 유전자를 전사 활성화하거나 미토콘드리아로 전위함으로써 전사 독립적인 방식으로 apoptosis를 유도할 수 있습니다44. 우리는 세포 노화에 따른 p53의 증가된 핵 전위를 관찰했는데, 패턴은 PCC1에 의해 현저하게 감소했지만 PCB2에 의한 것보다는 훨씬 적습니다(그림 1a). 4e, f). p53의 핵 배제는 노화 세포 사멸 유도의 중요한 단계이기 때문에45, 우리는 p53의 분포를 추가로 평가했습니다. 면역형광 염색은 PCC1 처리된 노화 세포에서 시토크롬 c 산화효소 소단위 IV(COX IV)(미토콘드리아 호흡 전자 사슬의 막관통 단백질 복합체, 종종 미토콘드리아 상주 단백질 마커로 사용됨)와 p53의 중첩이 상당히 증가한 것으로 나타났으며, 이는 p53을 미토콘드리아 기질로. 우리는 증식하는 세포의 미토콘드리아에서 일부 p53을 관찰했지만 PCC1은 증식하는 세포의 미토콘드리아 기질로 p53 단백질의 현저하거나 포괄적인 유입을 유도하지 않았습니다(그림 1a). 4f). 그러나 노화 세포에서 p53 수준은 핵에서 감소했지만 PCC1에 노출되면 미토콘드리아에서 증가했습니다 (그림 1b). 4g). 미토콘드리아 막 전위(Δψm) 감소는 미토콘드리아 매개 고유 경로를 통해 세포자멸사를 유발할 수 있는 이벤트입니다46. 우리는 Δψm이 노화 세포에서 유의하게 감소한 반면, 증식하는 세포는 JC-1 프로브 신호의 프로파일에 의해 표시된 바와 같이 PCC1의 존재하에 기본적으로 영향을 받지 않은 상태로 유지된다는 것을 발견했습니다(도 1c). 4시간). 따라서 PCC1은 ROS 생성을 촉진하고 시토크롬 c 방출을 유발하며 노화 세포에서 Δψm 교란을 유발하며, 본질적으로 미토콘드리아 장애 및 기능적으로 세포 사멸을 유도하는 사건과 관련이 있습니다. 함께, 우리의 실험 데이터는 노화 세포가 부상 그리고 퓨마 상향 조절 및 향상된 ROS 생산 및 미토콘드리아 기능 장애와 관련이 있습니다. 시험관 내에서 노화 세포를 제거하기 위한 PCC1의 능력과 선택성을 감안할 때, 우리는 다음으로 이 약제가 생체 내 노화 관련 병리를 방해하기 위해 악용될 수 있는지 여부를 조사했습니다. 임상 종양학에서 약물 내성은 대부분의 항암 치료의 효능을 제한하는 반면 노화 세포는 약물 손상 종양 미세 환경(TME)에서 생체 내 SASP의 개발을 통해 치료 내성에 자주 기여합니다.15,16,47. 치료유도노화세포의 약리학적 제거로 항암화학요법 부작용 최소화 및 동물에서 암 재발 방지48. 그러나, 항암 치료의 효능을 향상시키기 위한 원발성 종양의 노화 세포의 PCC1 매개 고갈의 가능성은 크게 알려지지 않았습니다. 첫째, 우리는 PSC27 세포와 고악성 전립선암 세포주인 PC3 세포를 사전 최적화된 비율(1:4)로 혼합하여 조직 재조합체를 구축하기로 결정했습니다.14. 그런 다음 세포를 비비만 당뇨병 및 중증 복합 면역결핍증(NOD-SCID)이 있는 마우스의 뒷 옆구리에 피하 이식했습니다. 동물의 종양은 8주의 기간이 끝날 때 측정되었고, 조직은 병리학적 평가를 위해 획득되었습니다. PC3 암세포와 나이브 PSC27 기질 세포를 포함하는 종양과 비교하여, PC3 세포와 노화 PSC27 세포로 구성된 이종이식편은 유의하게 증가된 부피를 나타내어 노화 세포의 종양 성장 촉진 효과를 확인했습니다(Extended Data Fig. 6a). 임상 조건을 모방하기 위해 우리는 유전독성 치료제 및/또는 세놀리틱스를 통합하는 전임상 요법을 실험적으로 설계했습니다(그림 1a). 5a). 피하 이식 2주 후 생체 내에서 안정적인 종양 흡수가 관찰된 경우 3주, 5주, 7주 중 1일에 mitoxantrone(MIT, 화학치료제) 또는 위약을 1회 투여하여 종료일까지 동물에게 투여하였다. 8주 요법(Extended Data Fig. 6b). 위약 치료군과 달리 MIT 투여는 종양 성장을 현저하게 지연시켜 화학 요법제로서의 MIT의 효능을 검증했습니다(종양 크기 44.0% 감소). 5b). 특히, PCC1 자체의 투여는 종양 수축을 일으키지 않았지만, MIT 치료 후 PCC1 전달(첫 MIT 투여 2주 후 복강내(ip) 주사를 통해 kg당 20mg으로 투여한 다음 격주 투여)은 종양 퇴행을 현저하게 향상시켰다(55.2 MIT 단독에 비해 종양 크기 % 감소, 위약 치료에 비해 종양 부피 74.9% 감소) 5b). ㅏ, 전임상 요법의 예시 다이어그램. 피하 이식 및 조직 재조합체의 생체내 흡수 2주 후, NOD-SCID 수컷 마우스는 여러 주기로 구성된 규칙적인 일정으로 단일(단일) 또는 복합(이중) 약제를 받았습니다. BLI, 생물발광 이미징. 비, 종양 말단 부피의 통계적 프로파일링. PC3 세포를 단독으로 또는 PSC27 세포와 함께 동물의 뒷 옆구리에 이종이식시켰다. 씨, SA-β-Gal 염색에 의한 생체 내 노화의 비교 평가. 동물을 죽인 후 종양을 신선하게 해부하고 조직학적 염색을 위해 냉동 절편으로 처리하였다. 스케일 바, 200μm. 디, 종양 조직에서 SA-β-Gal 염색의 비교 통계를 나타내는 바이올린 플롯. 그리고, 종양에서 분리된 기질 세포에서 여러 가지 정식 SASP 인자의 생체 내 발현에 대한 전사 분석. 기질 세포와 암세포 모두가 이종이식된 동물의 조직은 레이저 캡처 미세 해부 지원 분리 및 후속 과정을 거쳤습니다. 데이터는 세 가지 생물학적 복제를 나타냅니다(N = 그룹당 10마리). 데이터 세트는 상자와 수염 플롯으로 표시되며, 상자는 25번째 백분위수에서 75번째 백분위수까지 확장되며 중앙값은 중간에 선으로 표시되고 수염은 가장 작은 값과 가장 큰 값을 나타냅니다. 에프, 기질 세포의 SASP 전사체 프로파일링. 각 요인에 해당하는 신호는 비히클 처리 그룹의 신호로 정규화되었습니다. 메모 p16잉크4a 로도 알려져 있습니다 CDKN2A 그리고 p21CIP1 로도 알려져 있습니다 CDKN1A. G, 에 기술된 대로 수집된 생체 표본에서 DNA 손상이 있는 세포 및 세포 사멸 세포의 통계적 측정 ㅏ,비. 값은 히스톤 γH2AX 또는 카스파제 3(절단)에 특이적인 항체로 면역조직화학(IHC)에 의해 양성으로 염색된 세포의 백분율로 표시됩니다. 을위한 비,디-G, 피 값은 양측에 의해 계산되었습니다. 티- 테스트. 시간, 치료 요법의 끝에서 카스파제 3(절단, CC3)의 대표적인 IHC 이미지. 스케일 바, 100μm. 나, 진행성 부피가 큰 질병의 발병 후 사망한 마우스의 비교 생존. 생존 기간은 재조합 조직 주입 시점부터 동물이 죽을 때까지 계산되었습니다. MS, 중앙값 생존. 피 값은 양측 로그 순위(Mantel-Cox) 테스트에 의해 계산되었습니다. 데이터 씨,시간 세 가지 독립적인 실험을 대표합니다. 모든 막대 그래프의 데이터는 평균 ± sd로 표시되며 3개의 생물학적 복제를 나타냅니다. 우리는 다음으로 이들 동물의 종양 병소에서 세포 노화가 발생했는지 여부를 테스트했습니다. 당연히 MIT 투여는 종양 조직에서 많은 수의 노화 세포의 출현을 유도했습니다. 그러나 이러한 화학 요법 치료 동물에게 PCC1을 전달하면 대부분의 노화 세포가 고갈되었습니다(그림 1a). 5c,d). 레이저 캡처 현미해부 후 전사체 분석은 IL6, CXCL8, SPINK1, WNT16B (또한 ~으로 알려진 WNT16), GM-CSF (또한 ~으로 알려진 CSF2), MMP3 그리고 IL1A, 노화 마커 p16을 코딩하는 유전자의 상향 조절을 수반하는 경향잉크4a 화학요법을 받은 동물에서(Fig. 5e 및 확장 데이터 Fig. 6c). 이러한 변화는 주변 암세포보다는 기질 세포에서 주로 관찰되었으며, 이는 치료로 손상된 TME에서 후천적 내성을 자주 발생시키는 잔류 암세포의 재증식 가능성을 암시합니다. 그러나 PCC1 투여 시 전사 분석 및 RNA-seq에서 제안한 바와 같이 SASP 관련 변화가 크게 역전되었습니다(그림 1b). 5f 및 확장 데이터 Fig. 6d). MIT 처리 마우스에서 SASP 발현의 기본 메커니즘을 조사하기 위해, 우리는 GSE 전달의 첫 번째 용량(저항성 집락이 발달하기 전의 시점) 7일 후 이 두 약제로 처리된 동물의 종양을 해부했습니다. 위약 치료와 대조적으로 MIT 투여는 DNA 손상과 세포자멸사를 증가시켰지만 PCC1 단독 치료는 그렇지 않았습니다(그림 1a). 5g). 그러나 MIT 처리 동물에 PCC1을 공동 투여했을 때 DNA 손상과 세포 사멸이 크게 증가하여 화학 요법과 세놀리틱을 모두 받는 동물에서 세포 독성이 강화되었음을 의미했습니다. 뒷받침하는 증거로, 우리는 PCC1이 MIT와 함께 투여되었을 때 세포 사멸의 전형적인 특징인 카스파제 3 절단이 증가하는 것을 관찰했습니다(그림 1b). 5시간). 우리는 다음으로 시간이 지남에 따라 다른 동물 그룹의 생존을 비교하여 종양 진행의 결과를 평가했습니다. 이 전임상 코호트에서 동물은 종양 성장에 대해 모니터링되었으며, 종양 부담이 두드러지면 (크기 ≥ 2,000 mm3), 이전 연구에서 사용된 접근 방식14,49. MIT-PCC1 병용 치료를 받은 마우스는 MIT 단독 치료를 받은 그룹보다 최소 48.1% 더 오래 생존하는 가장 연장된 중앙값 생존을 보여주었습니다(그림 1a). 5i, 녹색 대 파란색). 그러나 PCC1 치료만으로는 생존 기간이 약간 연장되었습니다. 우리의 데이터는 PCC1 투여만으로는 종양 성장을 변화시키지 않고 동물 생존을 촉진하지 않는 반면, MIT와 PCC1의 동시 투여는 상당한 상승 효과를 갖는다는 것을 시사합니다. 참고로, 이 연구에서 수행된 치료는 요소, 크레아티닌 또는 간 효소 수준 또는 체중의 유의한 섭동이 관찰되지 않았기 때문에 동물이 잘 견디는 것으로 나타났습니다(확장 데이터 그림 2). 6e,f). 더 중요하게는, 이 연구에서 최적화된 용량으로 투여된 화학요법제 및 노인 보호제는 면역 적격 마우스에서도 면역계의 완전성 또는 중요한 기관의 조직 항상성을 크게 방해하지 않았습니다(보충 그림 2). 6a–c). 이러한 결과는 기존의 화학 요법과 결합된 노화 방지제가 심각한 전신 독성을 유발하지 않으면서 종양 반응을 향상시킬 가능성이 있다는 근거를 뒷받침합니다. 적은 수의 노화 세포라도 어린 동물의 신체 기능 장애를 유발할 수 있습니다.50. 우리는 PCC1이 생체 내에서 노화 세포를 선택적으로 죽여서 신체 기능 장애를 예방할 수 있는지 물었다. 이 질문을 해결하기 위해 우리는 대조군과 노화 마우스 배아 섬유아세포(MEF, 0.5 × 106 면당 세포) 구성적으로 루시퍼라제(LUC)를 발현+) 동계 야생형(WT) 마우스에 피하로 주입합니다. 이식 직후, 동물은 PCC1(ip 주사를 통해 kg당 20mg) 또는 비히클(10:30:60에 에탄올-폴리에틸렌 글리콜 400-Phosal 50 프로필렌 글리콜(PG))로 7일 동안 처리되었습니다(그림 1b). 6a). 우리는 발광 신호 강도가 노화 세포를 이식하고 PCC1로 처리한 마우스에서 비히클 처리된 한배 새끼의 것보다 유의하게 더 낮았지만, LUC로 이식된 마우스의 처리 후에는 차이가 관찰되지 않았다는 것을 발견했습니다.+ 대조군 세포(그림. 6b,c), 생체 내 PCC1의 세놀리틱 효능을 입증합니다. ㅏ, 5개월 된 C57BL/6J 수컷 마우스의 세포 이식 및 신체 기능 테스트를 위한 실험 절차의 개략도. 비, 마우스의 마지막 처리 후 2일째 생체내 루시페라제 활성을 나타내는 대표적인 이미지. 스케일 바, 20mm. 씨, 비히클 처리 동물의 평균 신호에 대한 백분율로 나타낸 이식된 세포의 발광. 디-에프, 최대 보행 속도 측정(기준선 기준)(디), 매달린 내구성(그리고) 및 그립 강도(에프) 5개월된 C57BL/6J 수컷 마우스에서 마지막 치료 1개월 후에 테스트를 수행했습니다. G, 이식 및 신체 기능 측정을 위한 실험 설계의 개략도. 시간-제이, 최대 보행 속도 측정(기준선 기준)(시간), 매달린 내구성(나) 및 그립 강도(제이) 28주령 C57BL/6J 수컷 마우스(마지막 처리 후 2주). 에게, 0.5 × 10이 이식된 17개월 동물의 1년 생존 곡선6 MEF 세포를 제어하고 비히클(CTRL-비히클)로 처리한 마우스와 0.5 × 10이 이식된 마우스6 비히클(SEN-비히클) 또는 PCC1(SEN-PCC1)으로 처리된 노화 MEF 세포. 빨간색 화살촉, 세포 이식(생후 528일) 또는 생존 측정 종료(생령 890일). 피 값은 양측 로그 순위(Mantel-Cox) 테스트에 의해 계산되었습니다. 엘, 노화 세포 이식 및 비히클 또는 PCC1 처리 후 질병 부담(좌측) 및 종양 부담(우측)(중앙값으로 사분위수 범위로 표시)의 비교 정량화. 중, 이식된 세포를 수용하고 비히클 또는 PCC1 치료를 받은 동물의 사망 원인. 을위한 디-에프,시간-제이, 데이터는 상자 수염 그림으로 표시되며, 상자는 25번째 백분위수에서 75번째 백분위수까지 확장되며 중앙값은 중간에 선으로 표시되고 수염은 가장 작은 값과 가장 큰 값을 나타냅니다. 을위한 씨-에프,시간-제이, 피 값은 양측에 의해 계산되었습니다. 티- 테스트. 동물의 수, N = 그룹당 5개 씨, N = 그룹당 10 디-제이, N = 27 에게 그리고 N = 13 엘,중. NS, 피 > 0.05; *피 <0.05; **피 <0.01; ***피 <0.001; ****피 <0.0001. 우리는 다음으로 PCC1을 사용하여 이식된 노화 세포를 죽이는 것이 병리학적 사건, 특히 신체적 기능 장애를 약화시킬 수 있는지 여부를 조사했습니다. 노화 세포 이식 후 1주일 동안 어린 동물을 PCC1으로 처리하면 최대 보행 속도(RotaRod), 매달리기 지구력(매달기 테스트) 및 악력(그립 미터)의 감소가 방지되었으며, 다른 쥐 그룹의 차량 처리 후 1개월 이내에 관찰된 변화 노화 세포는 PCC1이 신체적 기능 장애를 감소시킬 수 있는 가능성과 일치합니다(그림 1). 6d–f). PCC1 투여는 또한 노화 세포 이식 5주 후 동물에서 발생하는 신체 기능 장애를 예방했습니다(그림 1a). 6g). 노화 세포가 있는 마우스에서 PCC1 처리의 단일 5일 과정은 비히클 처리에 비해 신체 기능을 개선했습니다(그림 1a). 오전 6시~일). 참고로, 개선은 PCC1 치료 후 2주 후에 감지할 수 있었고 심지어 몇 개월 동안 지속되었습니다(Extended Data Fig. 7a,b). PCC1 투여의 이 두 시점(노화 세포 이식 직후 대 5주)에서, PCC1의 유익한 효과는 필적하는 것으로 보였다. 데이터는 PCC1 투여 일정이 유연할 수 있음을 시사하며 이는 잠재적 임상 가능성을 나타냅니다. 식물 종자 유래 프로시아니딘은 일반적으로 제거 반감기가 12시간 미만이므로51,52, PCC1 치료의 단일 과정에 따른 신체 기능의 지속적인 개선은 세놀리틱 제제를 사용한 지속적인 치료의 필요성을 회피하며, 추가로 PCC1의 활성이 노화 세포 유발 신체 기능 장애를 방지하기에 충분함을 암시합니다. 우리는 다음으로 중년 동물에서 노화 세포의 영향이나 제거의 이점을 평가하려고 했습니다. 이를 위해 대조군 또는 노화 MEF를 이식한 17개월 된 C57BL/6J 마우스를 사용했습니다. 특히 노화 세포를 가지고 있고 다음 해에 비히클 치료를 받은 동물의 생존은 PCC1 치료를 받은 동물보다 현저히 낮았고 사망 위험(위험 비율, 피 = 0.0172) (그림. 6k). 그러나 질병 부담, 사망 시 종양 부담 및 사망 원인은 비히클을 처리한 마우스와 PCC1을 처리한 마우스 간에 유의한 차이가 없었습니다(그림 1a). 6리터). 이러한 데이터는 소수의 노화 세포가 특정 병리 또는 몇 가지 개별 조건을 유발하기 보다는 노화의 진행을 가속화하는 것과 같은 일반적인 과정을 통해 생존에 영향을 미칠 수 있음을 시사합니다. 노화 세포 부담을 증가시키면 중년 사망률과 관련된 경향인 신체 기능 장애가 발생하지만 PCC1과 같은 세놀리틱 투여로 연기될 수 있습니다. 세놀리틱스는 다양한 병태생리학적 상황에서 다양한 조직과 기관의 노화 세포를 고갈시키며, 대부분은 노화와 관련이 있습니다.53. 유기체 및 유기체 노화의 노화 세포에 대한 PCC1의 영향을 추가로 조사하기 위해 치료에 도전한 마우스와 자연적으로 노화된 마우스를 포함하여 생체 내 노화의 두 가지 독립적인 동물 모델을 선택했습니다. 먼저, 우리는 WT 생쥐를 치사량 이하의 용량(5 Gy)으로 전신 조사(WBI)에 노출시켜 세포 노화를 유도했으며, 그 다음 단계인 PCC1(ip 주사를 통해 kg당 20mg) 또는 비히클(에탄올-폴리에틸렌)로 노인 보호 처리했습니다. 글리콜 400–Phosal 50 PG at 10:30:60) (일주일에 한 번) (그림. 7a). 참고로, WBI를 받은 동물은 현저하게 회색 머리카락을 포함하여 비정상적인 신체 모양을 나타내었지만 PCC1 투여에 의해 크게 반전되었습니다(그림 1b). 7b,c). SA-β-Gal-양성 노화 세포는 심장 및 폐 조직에서 증가된 염색 양성으로 입증된 바와 같이 이들 동물에서 생체내에서 유도되었다(도 1a). 7d,e). 그러나, 우리가 복강내 주사로 PCC1을 처리했을 때, 해부된 조직에서 SA-β-Gal-양성 세포의 비율은 WBI 후 단계에서 비히클 처리된 마우스의 비율과 달리 유의하게 감소했습니다(그림 1a). 7f,g). PCC1 처리는 또한 비히클 처리와 비교하여 노화 마커 및 주요 SASP 인자의 하위 집합의 발현을 감소시켰습니다(그림 2a). 7시간). 요약하면, 데이터는 PCC1이 SA-β-Gal-양성 세포를 효과적으로 고갈시키고 SASP 발현을 제어하며 마우스의 생체 내 조건에서 노화 세포 부담을 최소화할 수 있음을 시사합니다. ㅏ, WBI 및 신체 기능 테스트를 경험하는 마우스에 대한 실험 절차의 개략도. 비, 순진한 C57BL/6J 수컷 마우스의 전신 스냅샷 비교, WBI에 노출된 후 비히클 처리 또는 WBI에 노출되고 PCC1 처리됨. 씨, 에 설명된 동물의 우리 안에 있는 사진 ㅏ 전임상 조건에서. 디, 비히클 또는 PCC1 처리를 받은 미처리(순진한) 및 WBI 처리 마우스의 심장 조직의 SA-β-Gal 염색의 대표적인 이미지. 스케일 바, 200μm. 그리고, 에 기술된 바와 같이 마우스의 폐 조직의 SA-β-Gal 염색의 대표적인 이미지 디. 스케일 바, 200μm. 에프, 에서 조사된 동물의 심장 조직의 SA-β-Gal 염색의 비교 통계 디. G, 에서 조사된 동물의 폐 조직의 SA-β-Gal 염색의 비교 통계 그리고. 시간, 에 기술된 조건에서 처리된 동물로부터 수집된 조직의 전사 수준에서 SASP 발현의 정량적 측정 ㅏ. 나,제이, 런닝머신에서의 주행거리 측정(나) 및 그립 강도(제이) 실험용 쥐. 을위한 에프-제이, 피 값은 양측에 의해 계산되었습니다. 티- 테스트. 에게, WBI에 노출되고 비히클 또는 PCC1로 매주 처리된 C57BL/6J 마우스의 Kaplan-Meier 생존 분석, 처리되지 않은 대조군으로 순진한 마우스. CI, 신뢰 구간; HR, 위험 비율; DFI, 무병 기간. 피 값은 양측 로그 순위(Mantel-Cox) 테스트에 의해 계산되었습니다. 막대 그래프의 데이터는 평균 ± sd로 표시되며 세 가지 독립적인 실험을 나타냅니다. NS, 피 > 0.05; *피 <0.05; **피 <0.01; ***피 <0.001; ****피 <0.0001. 그런 다음 우리는 전임상 치료가 마우스의 물리적 매개변수에 미치는 영향을 평가했습니다. 예상대로 WBI는 차량 그룹에서 트레드밀 및 그립 강도 분석으로 측정한 운동 능력과 근력을 상당히 손상시켰습니다(그림 1b). 7i,j). 대조적으로, PCC1 투여는 상당한 이점을 제공하여 이러한 능력을 회복시켰다. 더 중요한 것은 PCC1 치료가 생존율을 증가시켰다는 점이다(Fig. 7천). 우리의 결과는 SA-β-Gal-양성 노화 세포의 PCC1 유도 제거가 노화 관련 물리적 퇴행을 완화하고 세포 독성 요법과 같은 환경 스트레스 요인에 의해 유발되는 조기 노화 환경에서 사망률을 줄이는 효과적인 전략이 될 수 있음을 나타냅니다. 우리는 다음으로 노화 세포가 자연적으로 노화되는 동물의 신체 기능에 미치는 영향을 정의하려고 했습니다. 이를 위해 정상적인 20개월 된 WT 마우스를 비히클(10:30:60에 에탄올-폴리에틸렌 글리콜 400-Phosal 50 PG) 또는 PCC1(ip 주사를 통해 kg당 20mg)(2주에 한 번)으로 처리했습니다. 4개월 동안(그림. 8a). 조직학적 평가는 노령 동물의 신장, 간, 폐 및 전립선에서 SA-β-Gal-양성 노화 세포의 비율이 유의하게 상승한 것으로 나타났으며, 이는 PCC1 처리에 의해 역전되었습니다(그림 1b). 8b, c 및 확장 데이터 Fig. 8a–f). 신체 테스트 결과 PCC1은 비히클 처리 동물과 비교하여 PCC1을 투여한 동물의 최대 보행 속도, 매달린 지구력, 악력, 러닝머신 지구력, 일상 활동 및 빔 균형 성능을 향상시켜 신체 기능 장애를 완화시키는 것으로 나타났습니다(그림 1a). 8d–i), 체중과 음식 섭취량은 PCC1 처리 마우스에서 크게 변하지 않았습니다(Extended Data Fig. 8g,h). 특히, SASP의 발현은 비히클 처리군과 비교하여 PCC1 처리된 노령 마우스의 폐와 같은 조직에서 유의하게 감소하였다(도 2a). 8j), PCC1으로 처리된 인간 기질 조직에 의한 SASP 인자의 더 적은 분비와 일치하는 패턴(도 1a). 5f). ㅏ, 4개월 동안 2주에 한 번(격주) PCC1을 처리한 20개월 된 C57BL/6J 수컷 마우스의 신체 검사를 위한 도식 설계. 비, 비히클 또는 PCC1로 처리된 젊고 나이든 마우스로부터 신장의 SA-β-Gal 염색의 대표적인 이미지. 스케일 바, 200μm. 씨, 에 설명된 대로 SA-β-Gal 염색의 정량화 비. 데이터는 평균 ± sd를 나타냅니다. 디-시간, 최대 보행 속도의 정량화(기준선 기준)(디), 매달린 내구성(그리고), 그립 강도(에프), 트레드밀 지구력(G) 및 일상 활동(시간) 4개월 처리 후 20개월된 C57BL/6J 수컷 마우스. 나, 저울을 건너는 데 필요한 시간의 정량화. 각 동물의 처리 전후 데이터 포인트를 연결하여 처리 효과를 직접 비교할 수 있습니다. 제이, 6개월 미처리(6M), 24개월 비히클 처리(24M 비히클) 및 24개월 PCC1 처리 마우스(24M-PCC1)에서 수집한 폐 조직에서 SASP 발현의 정량적 전사체 프로파일링 . 데이터는 평균 ± sd로 표시되며 3개의 생물학적 복제에서 파생되었습니다(N = 3개의 독립적인 분석). 에게, 생후 24-27개월의 생쥐(암수 모두)의 수명 분석을 위한 도식 설계. 엘,중, 치료 후 생존(엘) 및 평생 생존(중) PCC1을 격주로 처리한 C57BL/6J 동물의 곡선(N = 91; 남성 48명, 여성 43명) 또는 차량(N = 80; 남성 42명, 여성 38명) 생후 24~27개월부터 시작합니다. N, 지난 2개월 동안의 평균 최대 보행 속도 및 매달리기 지구력(N = 그룹당 마우스 10마리) 및 두 그룹 모두에서 가장 오래 사는 마우스(상위 20개)의 수명. 그만큼, 사망 시 질병 부담 및 종양 부담. 남녀 모두에게, N = 팔당 60마리의 마우스. 남성의 경우, N = 31 PCC1 및 N = 차량의 경우 33. 여성의 경우, N = PCC1의 경우 29 및 N = 차량의 경우 27. 을위한 씨-시간,제이, N = 3개의 생물학적으로 독립적인 분석. 데이터는 상자와 수염 플롯으로 표시되며, 상자는 중앙에 선으로 표시된 중앙값과 함께 상자가 25번째 백분위수에서 75번째 백분위수까지 확장되고 수염은 가장 작은 값과 가장 큰 값을 나타냅니다(디-시간,N) 또는 평균 ± sd(그만큼). 짝을 이루지 않은 쌍꺼풀 티-테스트(씨-제이,N,그만큼) 및 Cox 비례 위험 회귀 모델(엘,중) 통계적 유의성을 결정하는 데 사용되었습니다. WT 마우스의 남은 수명을 연장하기 위한 노화 세포 제거의 가능성을 확립하기 위해, 우리는 아주 노년기부터 PCC1 치료를 수행했습니다(그림 1a). 8k). 생후 24~27개월(인간의 경우 대략 75~90세)에 PCC1 투여(2주에 한 번 또는 격주로)를 받은 마우스는 치료 후 중앙값 수명이 64.2% 더 길었습니다(또는 전체적으로 9.4% 더 길었습니다. 수명) 및 낮은 사망률(65.0%, 피 < 0.0001) 비히클 처리군(Fig. 8리터). 이러한 데이터는 PCC1이 노령 마우스에서 연령 관련 사망의 위험을 상당히 감소시킬 수 있음을 나타냅니다. 우리는 다음으로 노령 동물의 사망률 감소가 노년의 이환율을 높이는 대가를 치르는지 여부를 조사했습니다. 우리는 죽을 때까지 매달 PCC1 또는 비히클을 처리한 실험용 마우스에서 신체 기능을 측정했습니다. PCC1을 처리한 마우스의 남은 수명이 더 길었음에도 불구하고, 생후 2개월 동안의 신체 기능은 비히클 처리된 마우스보다 유의하게 낮지 않았습니다(그림 1a). 8n). 부검 시 여러 연령 관련 병리, 종양 부담 및 사망 원인의 발생률은 PCC1 처리 및 비히클 처리 마우스 간에 유의한 차이가 없었습니다(그림 1b). 8o 및 확장 데이터 Fig. 9a,b). 그러나 SASP의 발현은 고형 장기에서 감소했는데, 이는 대표적인 SASP 마커인 인터루킨(IL)-6, 집락 자극 인자(CSF)2 및 단핵구 화학 유인 단백질(MCP)1의 순환 수준 감소와 대체로 양립 가능했습니다. 말초혈액(Extended Data Fig. 9c – f). 우리는 또한 CD3에서 SASP의 감소된 발현을 관찰했습니다.+ 말초 혈액의 T 세포(Extended Data Fig. 9g), p16의 강력한 증가를 나타내는 세포 계통잉크4a 인간의 노화 중 표현54. 또한, PCC1 처리는 지질 과산화 생성물 4-하이드록시노넨알(HNE)의 부가물 감소 및 산화 글루타티온에 대한 환원 비율의 증가로 입증되는 바와 같이 간 조직의 산화 스트레스를 감소시켰습니다(Extended Data Fig. 9h, 나는), 플라보노이드의 일반적인 특성과 일치하며, 이는 자유 라디칼에 대항하고 항산화 방어 시스템에 관여하여 항산화 활성을 발휘합니다.55,56. 요약하면, 세놀리틱 제제 PCC1은 GSE(또는 계피, 카카오, 사과 껍질 및 소나무 껍질 추출물과 같은 천연물에서 추출)에서 추출한 식물화학적 성분으로 노화 및 다른 세포의 부담을 줄일 수 있습니다. 친 염증성 표현형을 개발하고 생존 노화 관련 항 세포 사멸 경로에 본질적으로 의존하고 마우스에서 높은 이환율을 유발하지 않고 치료 후 수명을 증가시킵니다. 이에 우리는 이러한 치료 양식이 노년기에 투여되더라도 노화 관련 기능 장애를 현저하게 지연시키고 노화 관련 질병을 감소시키며 건강 상태를 개선할 수 있는 탁월한 잠재력을 갖고 있다는 원리 증명 증거를 제시하여 개선을 위한 새로운 길을 제공합니다. 미래노인의학에서의 건강수명과 수명. 노화는 거의 모든 유기체에서 점진적으로 기능 저하를 일으키는 본질적으로 불가피한 과정입니다. 영구적인 성장 정지 상태인 세포 노화는 최근 노화의 특징이자 동인으로 부상했습니다.3,57. 노화 세포는 시간이 지남에 따라 노화된 조직에 축적되고 병리학의 증가 목록에 기여합니다58. 프로제로이드 또는 자연적으로 노화된 마우스에서 노화 세포를 제거하면 건강 수명이 연장되고 수명이 연장되며 죽상경화증, 골관절염 및 신경퇴행성 질환을 포함하되 이에 국한되지 않는 노화 관련 장애 억제59,60,61,62. 연령 관련 연구의 최근 발전은 노화 세포, 특히 세놀리틱(senolytics) 또는 덜 공격적으로는 세노모픽(senomorphics)이라고 하는 새로운 종류의 노인 보호제를 선택적으로 표적화할 수 있는 약물에 대한 검색을 촉발했습니다. 현재까지 dasatinib 및 quercetin, fisetin, piperlongumine, 열 충격 단백질(HSP)90 억제제 및 ABT-263(navitoclax) 및 ABT-737(refs. 11,12,13,18,19,21,22). 그 중 BCL-2 억제제는 원래 림프종 치료제로 개발되었지만 가장 널리 사용되는 세놀리틱입니다. ABT-737은 BCL-2, BCL-xL 및 BCL-w를 표적으로 하지만 용해도와 경구 생체이용률이 낮습니다. 생체 내 사용에 더 효과적인 ABT-263은 주로 BCL-2 및 BCL-xL을 억제하는 반면 혈소판 감소증을 자주 유발합니다. 일부 세놀리틱 화합물의 현저한 부작용을 감안할 때 세놀리틱 활성은 있지만 세포독성이 감소된 새로운 화합물을 식별할 필요가 있습니다. 본 연구에서는 최적의 생체 내 효능과 안전성으로 노화 세포를 광범위하게 표적화할 수 있는 새로운 약제를 식별하기 위해 주로 천연물로 구성된 PDMA 기반 약물 라이브러리를 스크리닝했습니다. 그 결과, 우리는 천연 공급원에서 추출한 식물 화학 물질인 PCC1을 광범위한 세놀리틱 화합물로 확인했습니다. 특별한 장점으로, PCC1은 대안적으로 낮은 농도에서 사용되는 경우 SASP 발현을 최소화하기 위해 senomorphic 에이전트로 작용할 수 있습니다. PCC1의 이러한 유리한 특징은 실제로 GSE의 특징과 크게 유사하며, 이는 senomorphic 및 senolytic 효과를 모두 생성할 수 있습니다. 유전 및 약리학 전략은 노화를 지연시키고 질병을 통제하기 위해 노화 세포를 제거하는 일련의 이점을 입증했습니다. 세포 노화는 발암성 활성화, 유전독성 스트레스, 염증 반응 및 반복적 소진에 이르는 다양한 자극에 의해 유발될 수 있습니다. 몇몇 화합물은 광범위한 스펙트럼 세놀리틱으로 식별되는 반면, 다른 화합물은 특정 유형의 노화 세포에만 선택적입니다. 특이성의 차이는 주로 의도된 임상 용도에 따라 달라지는 세놀리틱의 개별 선택을 의미합니다. 최근 연구에 따르면 심장 배당체 계열에 속하는 천연 화합물인 ouabain이 노화 세포 제거와 암 치료에 모두 사용할 수 있는 세놀리틱 제제로 밝혀졌습니다. 후자는 이중 작용 기전을 통해 구현됩니다63. 이 연구에서 우리는 노화 세포의 세포 사멸을 선택적이고 특이적으로 유도하지만 증식 세포에 대한 세포 독성은 제한적인 또 다른 새롭고 강력한 천연 세놀리틱으로 PCC1을 발견했습니다.64. 참고로, PCC1은 낮은 농도에서 SASP 발현을 억제합니다. SASP 발현은 아피게닌 및 캠페롤과 같은 일부 식물 유래 플라보노이드가 공유하는 특성으로, 노화 세포가 노화 관련 상태에 미치는 영향을 제한하기 위해 senomorphic으로 작용할 수 있습니다.65,66. 노화 세포를 표적으로 하는 천연 물질의 이중 메커니즘을 공개한 연구는 거의 없지만, 최근 합성된 케르세틴 표면 기능화된 Fe3그만큼4 나노 입자는 AMP 활성화 단백질 키나제(AMPK) 활성을 향상시켜 인간 섬유아세포에서 세놀리틱(senolytic) 및 세노모픽(senomorphic) 잠재력을 모두 나타냈습니다.67. PCC1이 세놀리틱 효과를 달성하는 메커니즘은 복잡해 보이며 추가 연구가 필요합니다. 우리의 데이터는 PCC1이 미토콘드리아의 기능적 완전성을 손상시켜 Δψm을 손상시켜 ROS와 같은 자유 라디칼의 생성을 증가시키고 노화 세포에서 시토크롬 c 방출을 유발하지만 증식하는 세포에서는 그렇지 않음을 시사합니다. 이 특이성의 가능한 이유는 노화 세포가 탈분극된 원형질막을 발달시키는 경향이 있고 H의 농도가 증가하기 때문입니다.+ (참조. 64), PCC1의 동작에 더 취약하게 만들 수 있는 기능입니다. 참고로, 이러한 변경은 노화 세포 사멸을 결정적으로 촉진하는 사건인 프로-아폽토시스 인자, 특히 NOXA 및 PUMA의 상향 조절된 발현을 동반합니다. 프로시아니딘 계열 내에서, 그 구성원은 플라반-3-올 분자의 중합에서 유래하고 올리고머 또는 폴리머로 존재하는 것으로 알려져 있습니다.28, PCC1은 기능적으로 고유한 것 같습니다. 우리의 실험 데이터는 PCC1(삼량체)과 다른 프로시아니딘(대부분은 실제로 PCB2와 같은 단량체 또는 이량체임) 사이의 눈에 띄는 차이를 의미합니다. 우리는 프로시아니딘 계열 구성원을 종합적으로 분석하지 않았기 때문에 분자의 단량체 수가 항노화 가능성을 결정하는지 여부는 여전히 열려 있지만 흥미로운 질문이며 기본 메커니즘은 향후 계속 연구할 가치가 있습니다. 세포 노화 그 자체는 서로 다른 세포 기원과 환경적 자극에 의존하는 매우 이질적인 과정입니다.68. PCC1의 주요 기능 중 하나는 복제, 종양 유전자, 방사선 조사 및 화학 요법을 포함한 광범위한 세포 유형 및 스트레스 요인에서 노화 세포를 효율적으로 제거하는 능력입니다. 이 연구에서 우리는 조직 미세 환경의 주요 세포 유형인 인간 기질 세포, 섬유아세포, HUVEC 및 MSC에 미치는 영향에 대해 PCC1을 다른 보고된 세놀리틱과 비교했습니다. 보고된 바와 같이 ABT-263은 노화된 인간 배아 섬유아세포(HEF) 및 HUVEC를 제거하지만 인간 전-지방세포에는 거의 영향을 미치지 않습니다12,18. 다사티닙과 케르세틴의 병용은 용량 의존적 방식으로 3가지 유형의 노화 세포를 모두 고갈시킬 수 있지만 증식하는 세포에는 유독합니다.11,69,70. 세놀리틱 제제로 보고된 또 다른 천연 플라보노이드인 피세틴은 고농도에서만 노화된 HEF 및 전-지방세포에 적당한 효과를 나타냅니다.20,21. 대조적으로, PCC1은 세포 유형 의존성, 비노화 세포에서의 높은 독성 및 노화 세포에 대한 낮은 효율을 포함하는 이러한 한계를 극복할 가능성이 있다. 단독으로 사용할 경우 케르세틴(GSE의 또 다른 플라보노이드) 자체가 노화 간질 세포에 대한 세포 독성을 나타내었지만 그 효능은 일반적으로 PCC1보다 낮습니다(그림 1b와 비교). 2a,c 및 보충 그림. 3n 그리고 4n). 함께, PCC1은 ABT-263, dasatinib, quercetin 및 fisetin과 같은 많은 보고된 세놀리틱보다 더 넓은 범위의 세포 유형에 대해 높은 특이성과 효율성으로 우수한 세놀리틱 활성을 가지며 여러 주요 유형의 노화 유도제에 의해 생성된 노화 세포를 표적으로 할 수 있습니다. 우리는 PCC1이 생체 내 조건에서 노화 세포에 세포 사멸 유도 효과를 발휘한다는 것을 발견했습니다. PCC1은 치료 유도 노화 세포를 효과적으로 제거하고 고형 장기의 노화 마커를 감소시켜 생체 내에서 그 효과를 강조했습니다. 이 연구에서 우리는 또한 PCC1으로 자연 노화된 쥐를 치료하고 노화 세포, 만성 염증 및 신체 기능에 미치는 영향을 테스트했습니다. 첫째, PCC1 처리는 GSEA 분석에 의해 나타난 바와 같이 여러 조직에서 노화 세포를 고갈시키고 SASP 관련 시그니처를 감소시켰다. 둘째, PCC1은 노화된 간과 신장에서 SASP 관련 유전자의 발현을 억제하고 혈액 내 만성 저등급 염증을 감소시킬 수 있습니다. 셋째, PCC1은 노화된 생쥐에서 손상된 운동 기능, 균형, 지친 운동, 근력 및 자발적인 탐색을 완화했습니다. 가장 중요한 것은, PCC1 처리군에서 RotaRod 및 빔 밸런스 테스트에 대한 성능이 초기 전처리 조건에 비해 개선되었습니다. 종합적으로, 식물화학적 화합물 PCC1은 조직 미세 환경에서 노화 세포를 선택적으로 표적화하고 자연적으로 노화된 마우스에서 놀라운 생물학적 효과를 생성합니다. 화학적으로 합성된 대응물과 유사하게, 천연 유래 프로시아니딘은 항염증, 항관절염, 항알레르기 및 항암 활성을 나타내고, 활성산소를 제거하고 방사선 유발 과산화 활성을 억제합니다.36,71. 포도씨에서 가장 두드러지게 식물 물질에서 분리된 에피카테킨 삼량체로서 PCC1은 만성 병리학적 상태에서 건강상의 이점을 제공하는 것으로 나타났습니다72. 그러나 생체 내 PCC1의 독성 효과에 대한 철저한 평가는 잠재적인 임상 적용에 중요합니다. 우리의 데이터에 따르면 고농도(kg당 20mg) 및 고주파 PCC1(격주) 치료에는 명백한 전신 독성이 없었습니다. 요약하면, 우리의 연구는 광범위한 세포 유형에 걸쳐 노화 또는 치료로 손상된 조직의 노화 세포를 선택적으로 표적으로 하는 노인 보호 전략의 우월성과 상대적 안전성을 보여줍니다. 그러나 생체 내 PCC1 농도는 기관마다 다르고 투여 용량, 약력학 및 약동학에 따라 다르며 국소 농도가 일부 조직 유형에서 세놀리틱 효과를 달성하기에 충분히 높지 않을 수 있습니다. 이 경우, 종합적으로, 우리의 연구는 천연 공급원에서 유래하고 뚜렷한 효능을 지닌 세노치료제(세노형 및 세놀리틱 잠재력 모두를 가짐)로 건강 수명 연장 및 수명 연장 및 노화 관련 병리를 치료하기 위한 새로운 길을 엽니다. 우리의 전임상 분석에서 입증된 PCC1의 잠재적인 노화 방지 효과는 더 길고 건강한 삶을 달성한다는 전반적인 목표와 함께 PCC1의 추가 번역 및 임상 개발을 위한 좋은 지원을 제공합니다.기본
결과
낮은 농도의 GSE 억제 SASP 발현
GSE는 고농도에서 세놀리틱 활성을 가지고 있습니다.
GSE의 PCC1 성분에는 세놀리틱 활성이 있습니다.
PCC1은 노화 세포에서 미토콘드리아 기능 장애를 유도합니다
PCC1은 종양 퇴행을 촉진하고 내화학성을 감소시킵니다.

PCC1 치료에 따른 노화 세포 제거로 신체 기능 장애 완화
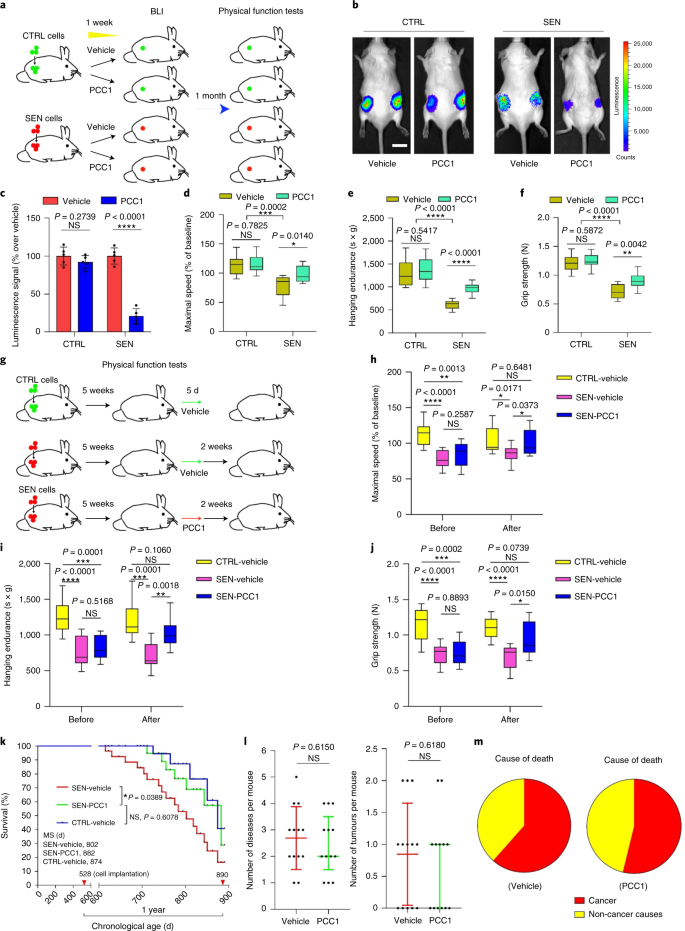
PCC1은 신체 기능을 유지하고 나이든 쥐의 생존을 연장합니다
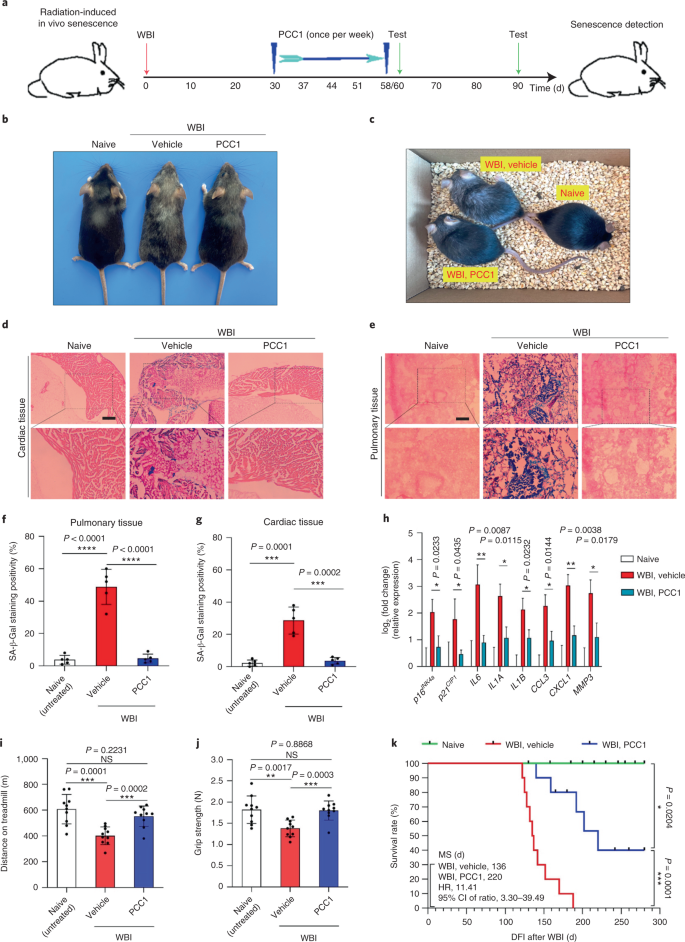
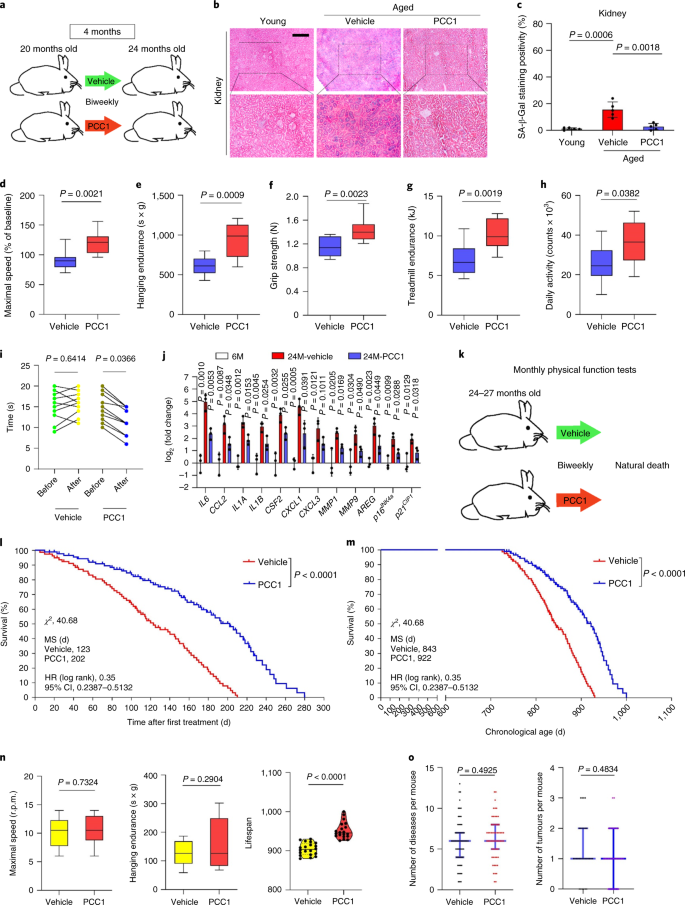
논의




